IDEA 2025.3 正式发布!一共修复了 800 多个问题!
Jetbrains刚刚发布了IntelliJ IDEA 2025.3 正式版!一共修复了 800 多个问题 ,在开发体验、Spring 支持、语言生态、构建工具、前端开发、性能优化等方面都有大幅提升。更重要的是,JetBrains 带来了期待已久的 统一发行版 ,让 IDE 更轻量、更稳定。
开放的集成式AI体验
JetBrains AI 不断演进,在 IDE 中 AI 的使用方式方面为您提供更多选择、更高的透明性和灵活性。
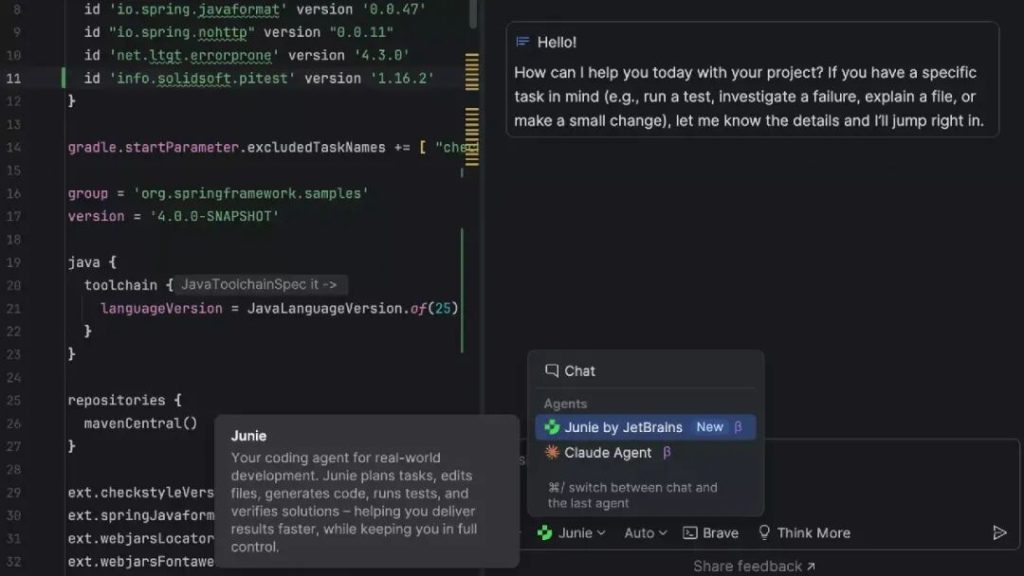
IntelliJ IDEA 新提供的多智能体体验可为您的开发工作流增添更大的灵活性和更多功能。 现在,可以在同一聊天界面中使用多个智能体,您可以在这些智能体之间无缝切换,为每项任务获得适当类型的辅助。 在集成 Junie 的同时,我们还原生集成了首个第三方 AI 智能体 – Claude Agent。
统一发行版:体积更小,质量更高
IntelliJ IDEA 2025.3 最大的变化,是将 Community Edition(社区版) 和 Ultimate Edition(旗舰版)合并为统一发行版。
统一后的版本:
• 不再需要为不同版本做多套测试与发布
• 减少构建链路复杂度
• 能够更集中资源提升整体质量
• 体积比旧 Ultimate 减少 30%
另外,长期存在的“更新后卸载程序无法正常工作”的问题也被彻底修复。
开发体验:更安静、更流畅的工作流程
在过去多个版本中,即使索引尚未完全完成,也可以开始工作,因为许多功能无需完整的索引即可运行。本次更新:
• 去除了关于索引不完整的无谓警告
• 将“Indexing”流程命名优化为更贴切的“Analyzing project”
• Find Usages 现在可以显示相对路径,定位更直观
• UI 与辅助技术(如屏幕阅读器)支持全面加强
• 新增 Islands Theme,活跃标签更显眼、可读性更强
语言支持:Java、Kotlin、Scala 全线增强
IntelliJ IDEA 2025.3 对 Spring Framework 7/Spring Boot 4 提供了全面支持,包括对 API 版本控制、HTTP 接口客户端、BeanRegistrar 动态注册 Bean、JSpecify 空安全注解等提供从识别、校验到跳转的完整支持。
IntelliJ IDEA 2025.3 持续保持对语言生态的高质量支持:
• Java:完善 Java 25 的方方面面,包括工具链、运行时兼容性、检查器修复
• Kotlin:重点增强对 Spring 生态的适配,同时推动迁移到 K2 模式
• Scala:支持 Structural Search & Replace,多项 UI 操作不再卡顿,提供可关闭内置检查以提升性能
GitHub / GitLab 集成
• 文件不再在打开时自动标记为已 reviewed
• 多行评论获得完整、清晰的 UI 支持
终端与构建工具优化
新的终端实现已在 PowerShell 中启用,为 Windows 用户带来性能改进、修复和视觉增强。
构建工具方面:
• Maven 和 Gradle 在运行 Micronaut 和 Spring 项目时更加稳定
• Dependency Analyzer 的交互体验得到优化
Web 开发:更好的模块解析和单体仓库支持
针对 TypeScript / JavaScript 大型单体仓库,本次版本带来重要增强:
• 理解 tsconfig.json 的 customConditions
• 识别 package.json 的 exports + development 条件
• TypeScript project references 能跨包正确解析
• 不再需要将 .mts 强行替换为 .mjs
• Node.js、Bun、Deno 都统一到一个 JavaScript Runtime 设置页
性能优化:响应更快、卡顿更少
此次版本继续围绕性能和稳定性改进,包括:
• UI 响应速度提升
• TypeScript 高亮大幅优化
• 修复 HTTP 客户端与代码导航的卡顿问题
• 大型项目整体操作更流畅